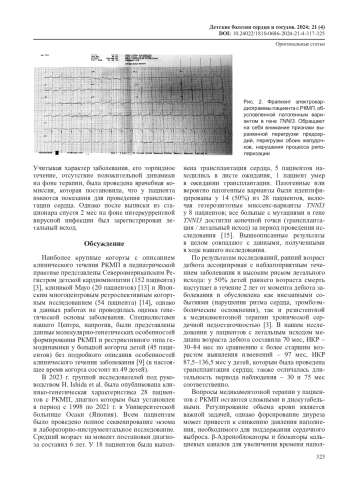
Цель исследования – проанализировать динамику клинических проявлений у детей с рестриктивной кардиомиопатией (РКМП), обусловленной мутациями в гене TNNI3.
Материал и методы. Проведено исследование, включающее наблюдение за 16 детьми в период с 2013 по 2024 г.
Результаты. У большинства пациентов с генетически детерминированной РКМП, обусловленной мутациями в гене TNNI3, семейный анамнез не был отягощен (94%), характер de novo установлен в 6 (37,5%) исследованных случаях (10 семей не были обследованы из-за отказа родителей). Как минимум 62,5% пациентов достигли конечной точки (летальный исход или трансплантация сердца) за период динамического наблюдения. Отмечалось более тяжелое течение заболевания у детей с дебютом в раннем возрасте на фоне крайне ограниченных возможностей медикаментозной терапии и потребностей в хирургическом лечении в короткие сроки после дебюта заболевания. В качестве иллюстрации приведен клинический пример течения заболевания у ребенка раннего возраста.
Заключение. Генетическая верификация диагноза помогает сделать прогноз заболевания, который является крайне неблагоприятным у пациентов с РКМП, обусловленной мутациями в гене TNNI3, а также решить вопрос о своевременном проведении трансплантации сердца.
Идентификаторы и классификаторы
Рестриктивная кардиомиопатия (РКМП) остается одним из наиболее редких фенотипов кардиомиопатий, ее представленность в структуре кардиомиопатий колеблется от 2,6 до 5%, по данным разных исследователей [1, 2]. Эхокардиографические критерии диагностики включают в себя нарушение диастолической функции миокарда по рестриктивному типу, дилатацию предсердий при практически неизмененной морфологии желудочков с сохранной сократительной способностью миокарда.
Список литературы
1. Elliott P., Charron P., Blanes J.R.G., Tavazzi L., Tendera M., Konte M. et al. European cardiomyopathy pilot registry: EURObservational research programme of the European society of cardiology. Eur. Heart J. 2016; 37 (2): 164–173. DOI: 10.1093/eurheartj/ehv497
2. Bott-Silverman C., Aksut B. Dilated and restrictive cardiomyopathies. Cleveland Clinic. Center for Continuing Education. 2015. Available at: https://www.clevelandclinicmeded. com/medicalpubs/diseasemanagement/cardiology/dilatedrestrictive- cardiomyopathy/#table01 (accessed September 10, 2024).
3. Webber S.A., Lipshultz S.E., Sleeper L.A., Lu M., Wilkinson J.D., Addonizio L.J. et al. Outcomes of restrictive cardiomyopathy in childhood and the influence of phenotype: a report from the pediatric cardiomyopathy registry. Circulation. 2012; 126 (10): 1237–1244. DOI: 10.1161/ CIRCULATIONAHA.112.104638
4. Rapezzi C., Aimo A., Barison A., Emdin M., Porcari A., Linhart A. et al. Restrictive cardiomyopathy: definition and diagnosis. Eur. Heart J. 2022; 43 (45): 4679–4693. DOI: 10.1093/eurheartj/ehac543
5. Chien K.R. Genotype, phenotype: upstairs, downstairs in the family of cardiomyopathies. J. Clin. Invest. 2003; 111 (2): 175–178. DOI: 10.1172/JCI17612
6. Carballo S., Robinson P., Otway R., Fatkin D., Jongbloed J.D.H., de Jonge N. et al. Identification and functional characterization of cardiac troponin I as a novel disease gene in autosomal dominant dilated cardiomyopathy. Circ. Res. 2009; 105: 375–382.
7. Doolan A., Tebo M., Ingles J., Nguyen L., Tsoutsman T., Lam L. et al. Cardiac troponin I mutations in Australian families with hypertrophic cardiomyopathy: clinical, genetic and functional consequences. J. Mol. Cell. Cardiol. 2005; 38 (2): 387–393. DOI: 10.1016/j.yjmcc.2004.12.006
8. Mogensen J., Kubo T., Duque M., Uribe W., Shaw A., Murphy R. et al. Idiopathic restrictive cardiomyopathy is part of the clinical expression of cardiac troponin I mutations. J. Clin. Invest. 2003; 111 (2): 209–216. DOI: 10.1172/JCI16336
9. Савостьянов К.В., Басаргина Е.Н., Рябова Е.Е., Пушков А.А., Жанин И.С., Басаргина Е.Ю. и др. Молекулярно- генетические особенности формирования рестриктивной кардиомиопатии у российских детей. Российский кардиологический журнал. 2021; 26 (10): 4590. DOI: 10.15829/1560-4071-2021-4590 Savostyanov K.V., Basargina E.N., Ryabova E.E., Pushkov A.A., Zhanin I.S., Basargina E.Yu. et al. Molecular genetic features of the development of rectrictive cardiomyopathy in Russian children. Russian Journal of Cardiology. 2021; 26 (10): 4590 (in Russ.). DOI: 10.15829/1560- 4071-2021-4590
10. Савостьянов К.В. Современные алгоритмы генетической диагностики редких наследственных болезней у российских пациентов: Информационные материалы. М.: Полиграфист и издатель; 2022. Savostyanov K.V. Modern algorithms for genetic diagnostics of rare hereditary diseases in Russian patients: Information materials. Moscow; 2022 (in Russ.).
11. Rai T.S., Ahmad S., Ahluwalia T.S., Ahuja M., Bahl A., Saikia U.N. et al. Genetic and clinical profile of Indian patients of idiopathic restrictive cardiomyopathy with and without hypertrophy. Mol. Cell. Biochem. 2009; 331 (1–2): 187–192. DOI: 10.1007/s11010-009-0157-7
12. Kaski J.P., Syrris P., Esteban M.T.T., Jenkins S., Pantazis A., Deanfield J.E. et al. Prevalence of sarcomere protein gene mutations in preadolescent children with hypertrophic cardiomyopathy. Circulation. Cardiovascular Genetics. 2009; 2 (5): 436–441. DOI: 10.1161/CIRCGENETICS. 108.821314
13. Anderson H.N., Cetta F., Driscoll D.J., Olson T.M., Ackerman M.J., Johnson J.N. Idiopathic restrictive cardiomyopathy in children and young adults. Am. J. Cardiol. 2018; 121: 1266–1270. DOI: 10.1016/j.amjcard.2018.01.045
14. Mori H., Kogaki S., Ishida H., Yoshikawa T., Shindo T., Inuzuka R. et al. Outcomes of restrictive cardiomyopathy in Japanese children – a retrospective cohort study. Circ. J. 2022; 86: 1943–1949. DOI: 10.1253/circj.CJ-21-0706
15. Ishida H., Narita J., Ishii R., Tsuru H. Wang R., Yoshihara R. et al. Clinical outcomes and genetic analyses of restrictive cardiomyopathy in children. Circ. Genom. Precis. Med. 2023; 16: e004054. DOI: 10.1161/CIRCGEN.122.004054
16. Bogle C., Colan S.D., Miyamoto S.D., Choudhry S., Baez- Hernandez N., Brickler M.M. et al. American Heart Association Young Hearts Pediatric Heart Failure and Transplantation Committee of the Council on Lifelong Congenital Heart Disease and Heart Health in the Young (Young Hearts). Treatment strategies for cardiomyopathy in children: a scientific statement from the American Heart Association. Circulation. 2023; 148 (2): 174–195. DOI: 10.1161/CIR.0000000000001151
17. Denfield S.W. Overview of pediatric restrictive cardiomyopathy: 2021. Prog. Pediatr. Cardiol. 2021; 62: 101415. DOI: 10.1016/j.ppedcard.2021.101415
18. Lorts A., Conway J., Schweiger M., Adachi I., Amdani S., Auerbach S.R. et al. ISHLT consensus statement for the selection and management of pediatric and congenital heart disease patients on ventricular assist devices. J. Heart Lung. Transplant. 2021; 40: 709–732. DOI: 10.1016/j.healun. 2021.04.015
19. Amdani S., Boyle G., Saarel E.V., Godown J., Liu W., Worley S. et al. Waitlist and post-heart transplant outcomes for children with nondilated cardiomyopathy. Ann. Thorac. Surg. 2021; 112: 188–196. DOI: 10.1016/j.athoracsur.2020.05.170
20. Lipshultz S.E., Cochran T.R., Briston D.A., Brown S.R., Sambatakos P.J., Miller T.L. et al. Pediatric cardiomyopathies: causes, epidemiology, clinical course, preventive strategies and therapies. Future. Cardiol. 2013; 9: 817–848. DOI: 10.2217/fca.13.66
Выпуск
Другие статьи выпуска
Синдром удлиненного интервала QT (СУИQТ) – заболевание с высоким риском развития опасных аритмий. В статье представлены результаты ЭКГ-обследования, велоэргометрии и холтеровского мониторирования пациентки 16 лет с синкопальными состояниями в анамнезе. На ЭКГ отмечено удлинение корригированного интервала QT (QTc) до 522 мс с поздним началом зубца T. Генетический тест подтвердил тип LQT3 (мутация в гене SCN5A). При холтеровском мониторировании и велоэргометрии была впервые выявлена альтернация комплекса QRS в сочетании с альтернацией зубца T (АQRS/TA). Проведен обзор литературы по проблеме.
АQRS/TA – это новый паттерн ЭКГ у пациентов с LQT3, который с высокой вероятностью отражает повышенную аритмогенную готовность миокарда у таких больных. Однако это предположение требует дальнейшего изучения и наблюдения.
Цель исследования – изучить структурно-функциональное состояние правых отделов сердца у молодых пациентов с желудочковой электрокардиостимуляцией в отдаленном послеоперационном периоде.
Материал и методы. Обследованы 58 пациентов (34 мужчины и 24 женщины) с имплантированными электрокардиостимуляторами (ЭКС) по поводу атриовентрикулярной (АВ) блокады. В зависимости от причины возникновения АВ-блокады пациентов разделили на две группы. В 1-ю группу (ЭКС+, ВПС+) вошли 28 человек с постоянным ЭКС, имплантированным после хирургической коррекции врожденного порока сердца по поводу возникшей послеоперационной АВ-блокады; во 2-ю группу (ЭКС+, ВПС-) – 30 человек с нехирургической АВ-блокадой, потребовавшей имплантации постоянного ЭКС. Всем пациентам проведены общеклиническое обследование, эхокардиография. Возраст пациентов на момент исследования составил: в 1-й группе – 21,7 (19,2; 23,3) года, во 2-й группе – 22,7 (20,1; 24,7) года; длительность электрокардиостимуляции – 15,9 (13,5; 18,2) и 15,7 (13,9; 18,5) года соответственно. Всем пациентам обеих групп на момент исследования были имплантированы двухкамерные ЭКС со 100% желудочковой стимуляцией.
Результаты. При анализе данных эхокардиографии установлено, что у пациентов 1-й группы статистически значимо большие размеры правого предсердия (ПП) по сравнению со 2-й группой: индекс объема ПП – 27,2 (23,6; 32,2) и 24,2 (21,6; 27,7) мл/м2 соответственно (U = 287,0, р = 0,039). У пациентов 1-й группы в сравнении со 2-й группой установлено значимое снижение показателей продольной функции правого желудочка (ПЖ): значения S’ составили 9,0 (8,3; 10,0) и 11,0 (11,0; 13,0) см/с соответственно (р = 0,000); TAPSE – 15,0 (13,0; 16,0) и 19,0 (18,0; 21,0) мм соответственно (р = 0,000). Показатель фракционного изменения площади (ФИП) в группах значимо не отличался и составил 51,2 (45,2; 56,2) и 46,7 (43,4; 53,2)% соответственно (U = 313,5, р = 0,098). Признаки диастолической дисфункции выявлены у 89% пациентов 1-й группы и 53% исследуемых 2-й группы (F = 0,156, p = 0,004). При оценке тяжести патологии клапанного аппарата правых отделов сердца установлено, что у пациентов 1-й группы выраженная регургитация на трикуспидальном клапане (ТК) имелась в 21%, а умеренно выраженная регургитация на клапане легочной артерии (КЛА) – в 36% случаев. У пациентов 2-й группы выраженная регургитация на ТК не регистрировалась (F = 0,124, p = 0,009) и умеренно выраженная недостаточность на КЛА выявлена у 1 пациента (F = 0,170, p = 0,002). Прогрессирование недостаточности на ТК до умеренной и выше отмечено у 78,5% исследуемых 1-й группы и 94,0% пациентов 2-й группы.
Заключение. У пациентов с послеоперационной АВ-блокадой, возникшей после хирургического лечения ВПС, в отдаленном послеоперационном периоде отмечены расширение полости ПП и снижение продольной функции ПЖ, при нормальных значениях ФИП. У пациентов с нехирургической АВ-блокадой не выявлено значимых нарушений геометрии правых отделов сердца и систолической функции ПЖ при наличии умеренной регургитации на ТК.
Цель исследования – определить представленность повышенной трабекулярности и некомпактной кардиомиопатии в когорте больных с катехоламинергической полиморфной желудочковой тахикардией (КПЖТ).
Материал и методы. В исследование включены 68 больных с КПЖТ, наблюдающихся в Институте им. Ю. Е. Вельтищева. Для выявления наличия структурных изменений всем больным проведена эхокардиография экспертного класса, магнитно-резонансная томография сердца по показаниям.
Результаты. У детей с КПЖТ частота повышенной трабекулярности миокарда левого желудочка / некомпактной кардиомиопатии составила 24% случаев.
Заключение. У больных с КПЖТ ассоциированным структурным изменением миокарда является повышенная трабекулярность миокарда левого желудочка и некомпактная кардиомиопатия.
Цель исследования – сравнение особенностей течения и исходов саркомерной и РАС-ассоциированной гипертрофической кардиомиопатии (ГКМП) у детей с дебютом на 1-м году жизни.
Материал и методы. По результатам генетического исследования отобраны 36 пациентов с мутациями в генах саркомерных белков и RAS-MAPK сигнального пути. В данных группах проведен сравнительный анализ клинического статуса, лабораторно-инструментальных данных, а также исходов. Разница между группами оценивалась с помощью методов биомедицинской статистики.
Результаты. У 17 (47%) пациентов наблюдались мутации в генах саркомерных белков, у 19 (53%) – в RAS-MAPK сигнального пути. Среди саркомерных мутаций в данной возрастной группе преобладали мутации в гене MYH7 (58,8%, n = 10), а в группе РАС-ассоциированной ГКМП – PTPN11 (42,11%, n = 8) и RAF1 (42,11%, n = 8). У детей с РАСопатиями наблюдалась высокая частота встречаемости врожденных пороков развития органов и систем, а также ВПС (p < 0,05). Бивентрикулярная форма ГКМП выявлена у 14 (38,9%) детей, обструктивная форма – у 17 (47,2%) пациентов. Общая выживаемость на сегодняшний момент (средняя длительность наблюдения 10 [6,0; 20,0] лет) составляет 83,3% (n = 30). Зарегистрировано 6 летальных исходов (по 3 в каждой группе). Общая выживаемость к 5 годам жизни среди всех детей составила 91,7% [95% ДИ 96,4–87,1%], к 10 годам жизни – 88,6% [95% ДИ 93,9–83,2%]. Имплантируемый кардиовертер-дефибриллятор был установлен 4 (23,5%) детям только с саркомерной ГКМП. Миоэктомия проведена 9 (25%) пациентам.
Заключение. Течение ГКМП у детей с дебютом до года характеризуется высокой летальностью. Дети с РАСопатиями представляют особую группу риска в раннем возрасте.
Цель исследования – оценить распространенность тахииндуцированной кардиомиопатии (ТКМП) и выявить факторы, ассоциированные с риском развития ТКМП у детей с идиопатическими желудочковыми аритмиями (ЖА).
Материал и методы. В ретроспективное исследование включены 392 ребенка с идиопатическими ЖА, которым было проведено лечение в НМИЦ им. В. А. Алмазова в 2011–2023 гг. В 1-ю группу вошли 35 (8,9%) пациентов с наличием ТКМП, в группу 2 – 357 (91,1%) пациентов без критериев ТКМП. Всем пациентам с ТКМП проводилась оценка эхокардиографических данных через 2 и 6 мес после старта терапии или проведения катетерной аблации.
Результаты. Распространенность ТКПМ у детей с идиопатическими ЖА составила 8,9%. В ходе исследования были выявлены статистически значимые факторы риска формирования ТКМП у детей с ЖА: возраст 12 лет и старше (p = 0,008), наличие жалоб на повышенную утомляемость (p = 0,040) и пресинкопальные/синкопальные состояния (p = 0,035), наличие парных желудочковых экстрасистол (ЖЭ) (p = 0,010) и желудочковой тахикардии (ЖТ) (p = 0,002). Методом ROC-анализа установлено, что суточная плотность желудочковой эктопии 36,8% и более ассоциируется с развитием ТКМП (p < 0,001). Чувствительность и специфичность модели составили 76,5 и 78,1% соответственно.
Заключение. Такие факторы, как возраст 12 лет и старше, наличие симптомов, парных ЖЭ, ЖТ, а также плотность ЖА, могут использоваться в клинической практике в качестве предикторов формирования ТКМП у детей с идиопатическими ЖА.
Цель исследования – изучить влияние мутаций генов, ответственных за развитие семейной гиперхолестеринемии (СГХС), и липидного профиля на структурно-морфологическое состояние сосудов по показателям толщины комплекса интима–медиа (тКИМ) общей сонной артерии у детей с гетерозиготной семейной гиперхолестеринемией.
Материал и методы. Исследование проводилось в период с 2019 по 2023 г. и включало 214 детей в возрасте от 2 до 17 лет. Группу сравнения составили 107 детей. В основную группу вошли 107 пациентов с диагнозом «семейная гиперхолестеринемия, гетерозиготная форма», которые были разделены на три группы в зависимости от генофенотипа заболевания: группа 2 – дети с положительным фенотипом и с идентифицированными мутациями, ассоциированными с СГХС: LDLR, APOB, PCSK9, LDLRAP1; группа 3 – дети с положительным фенотипом, но не выявленными мутациями; группа 4 – дети с отрицательным фенотипом и положительным генотипом. Всем детям проводились клинико-лабораторная диагностика, УЗИ сосудов шеи с оценкой тКИМ общей сонной артерии. Пациентам основной группы было проведено секвенирование нового поколения с применением панели генов: LDLR, APOB, PCSK9, LDLRAP1.
Результаты. У пациентов 2-й и 3-й групп выявлено статистически значимое увеличение показателей общего холестерина (ОХ), липопротеинов низкой плотности (ЛПНП) и тКИМ относительно группы сравнения. Значения тКИМ были достоверно больше у детей 2-й группы относительно 3-й, при этом показатели липидов у них не отличались. В 4-й группе показатели ЛПНП и тКИМ были достоверно ниже аналогичных показателей 2-й группы. Наиболее распространенными вариантами LDLR оказались: c.986G>A, c.906C>G, c.1187-10G>A. Увеличение тКИМ было достоверно выше у пациентов с c.1187-10G>A относительно c.906C>G.
Заключение. Пациенты с СГХС характеризовались увеличенными уровнями ОХ, ЛПНП и большей тКИМ в отличие от здоровых сверстников. У детей с идентифицированной мутацией в генах, ассоциированных с СГХС, установлены признаки сосудистого ремоделирования с 8-летнего возраста по сравнению с детьми с фенотипической СГХС. Полученные результаты подчеркивают важность ранней диагностики, в том числе генетической, и постоянного мониторинга состояния сосудистой стенки пациентов с СГХС для предотвращения прогрессирования атеросклероза начиная с детского возраста.
Мышечная дистрофия Дюшенна (МДД) в настоящее время представляет собой одну из самых изучаемых прогрессирующих мышечных дистрофий, в отношении которой ведется интенсивная разработка новых фармакологических методов лечения, направленных на коррекцию генетического дефекта и восстановление экспрессии дистрофина. Самыми многообещающими и наиболее перспективными подходами для терапии являются пропуск экзона и технология первичного редактирования с помощью CRISPR/Cas9. Однако, несмотря на эффективность новых методик лечения, большую роль в определении прогноза и продолжительности жизни больных с МДД продолжает играть неуклонно развивающаяся кардиомиопатия, приводящая к декомпенсированной сердечной недостаточности и жизнеугрожающим нарушениям ритма. Прогрессирование кардиомиопатии влияет на доступность всех новых методов лечения, снижая их эффективность и общую функциональную пользу. Поэтому в лечении МДД важен комбинированный подход, включающий в себя как генную терапию, направленную на восстановление экспрессии дистрофина, так и терапию, ориентированную на улучшение выживаемости структурно неполноценных кардиомиоцитов, уменьшение выраженности фиброза миокарда и смягчение дистрофических процессов. В данном обзоре приводится современный взгляд на концепцию единства медикаментозных, хирургических и генотерапевтических методов лечения МДД, целью которых является уменьшение выраженности миокардиальной дисфункции.
Статистика статьи
Статистика просмотров за 2025 год.
Издательство
- Издательство
- ФГБУ НМИЦ ССХ ИМ. А.Н. БАКУЛЕВА МИНЗДРАВА РОССИИ
- Регион
- Россия, Москва
- Почтовый адрес
- 121552, Москва, Рублевское шоссе, д. 135.
- Юр. адрес
- 119049, г Москва, р-н Якиманка, Ленинский пр-кт, д 8
- ФИО
- Голухова Елена Зеликовна (ДИРЕКТОР)
- Контактный телефон
- +7 (495) 4147984
- Сайт
- https://bakulev.ru/